

彭汉勇课题组||Angew||低温介导锰基纳米制剂组装及其肿瘤成像与治疗
2025年4月,环境化学与生态毒理学国家重点实验室彭汉勇课题组在核酸纳米合成技术方向取得新进展,研究成果以“Spherical Nucleic Acids-Directed Cryosynthesis of Manganese Nanoagents for Tumor Imaging and Therapy”为题发表在Angewandte Chemie International Edition期刊上。
DNA酶(DNAzyme)作为一类具有催化功能的核酸分子,可通过特异性识别并切割肿瘤相关mRNA分子,在肿瘤的分子诊断与靶向治疗领域展现出革命性应用前景。然而其生物医学转化面临双重挑战:一方面,细胞内源性金属辅因子(如Mn2+)浓度难以满足DNAzyme激活的催化需求;另一方面,外源性补充的游离Mn2+因血液半衰期短及非特异性分布,导致其在病灶部位的有效富集度与治疗效能显著受限。针对上述瓶颈问题,当前研究主要基于二氧化锰(MnO2)或磷酸钙(Mn/Ca-PO4)等锰基纳米递送系统,通过肿瘤微环境响应机制(如谷胱甘肽介导的还原反应)实现可控释放活性Mn2+,同时延长其体内循环时间。但现行合成策略存在显著缺陷:材料制备过程中的掺杂工艺及高价态锰(Mn4+)的还原依赖性,导致Mn2+负载容量受限,且存在生物降解动力学迟缓、活性组分释放效率低下等问题。因此,开发简便可控的合成与释放策略,并构建新型高效多功能锰基纳米载体体系,成为当前实现DNAzyme精准诊疗效能最大化的亟待突破的关键问题。
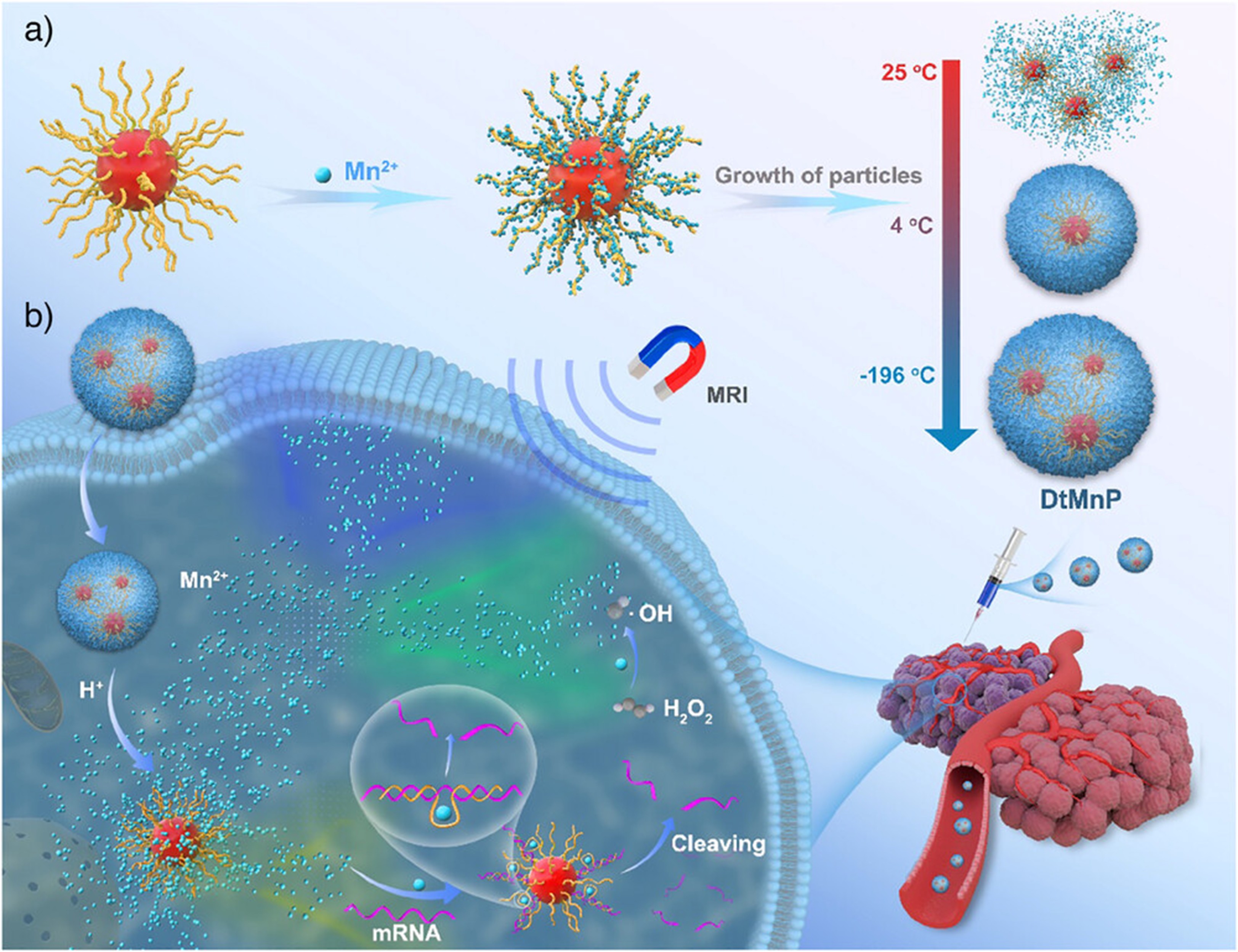
图1. 多功能DNA模板化碳酸锰纳米颗粒(DtMnP)的制备与诊疗应用
环境化学与生态毒理学国家重点实验室彭汉勇团队开发了一种温度调控的合成策略,用于制备多功能DNA模板化碳酸锰纳米颗粒(DtMnP)。该制备过程包含三个阶段:(1)以球形核酸(DNAzyme功能化的金纳米颗粒)为支架,通过磷酸配位实现Mn2+可控沉积,引发碳酸锰的异相成核;(2)通过调节温度来改变碳酸锰的溶解常数(Ksp),在液氮条件下快速冷冻促使纳米颗粒沿DNA模板生长;(3)冷冻干燥使纳米颗粒稳定,便于长期稳定保存,避免了传统纳米颗粒溶液常见的聚集问题。
DtMnP具有pH响应性释放的特点,在肿瘤微酸环境条件(pH 5.5)下,60分钟内可释放出90%的Mn2+。释放的Mn2+具有双重功能:(1)触发磁共振成像(MRI)的信号放大,实现MCF-7肿瘤的成像,并具有良好的生物安全性;(2)通过DNAzyme介导的EGR-1基因沉默(使mRNA下调60%),并结合Mn2+催化的芬顿反应产生具有细胞毒性的羟基自由基实现化学动力治疗(使MCF-7细胞凋亡率达到45%),从而发挥协同治疗的功效。
该温度调控型核酸导向合成策略创新性地建立了一种普适性平台技术,不仅实现了多功能纳米颗粒的可控构筑,更通过核酸序列的模块化与功能化设计构建了灵活可编程的载体系统,显著提升了诊疗功能元件的按需组装能力。这种兼具肿瘤微环境响应特性和结构稳定性的纳米体系,为发展"诊-疗"联动的一体化纳米制剂提供了创新性技术路径。
该论文的第一作者为助理研究员谢文菁、硕士研究生郝强军和硕士研究生叶子,通讯作者为中国科学院生态环境研究中心彭汉勇研究员。该工作得到了国家重点研发计划、中国科学院基础与交叉前沿科研先导专项(B类) 、国家自然科学基金委面上项目、青年基金等项目的支持。
Spherical Nucleic Acids-Directed Cryosynthesis of Manganese Nanoagents for Tumor Imaging and Therapy. Wenjing Xie+, Qiangjun Hao+, Zi Ye+, Rui Sha, Bei Wen, Hailin Wang, Hongquan Zhang, Guohua Jia, X. Chris Le, Guibin Jiang, and Hanyong Peng*. Angew.Chem. Int. Ed. 2025,e202503004
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202503004