



高明等在污染物诱发肺肝损伤的分子机制研究中取得新进展
2022年9月22日,环境化学与生态毒理学国家重点实验室刘思金课题组高明副研究员在环境污染物诱发肺肝损伤的分子机制研究中取得一系列进展,相关成果发表在Journal of Biological Chemistry (Gao, et al. J Biol Chem. 2022), Oncogene (Gao, et al. Oncogene. 2022)和Nano Today (Qi, et al. Nano Today. 2022)上。
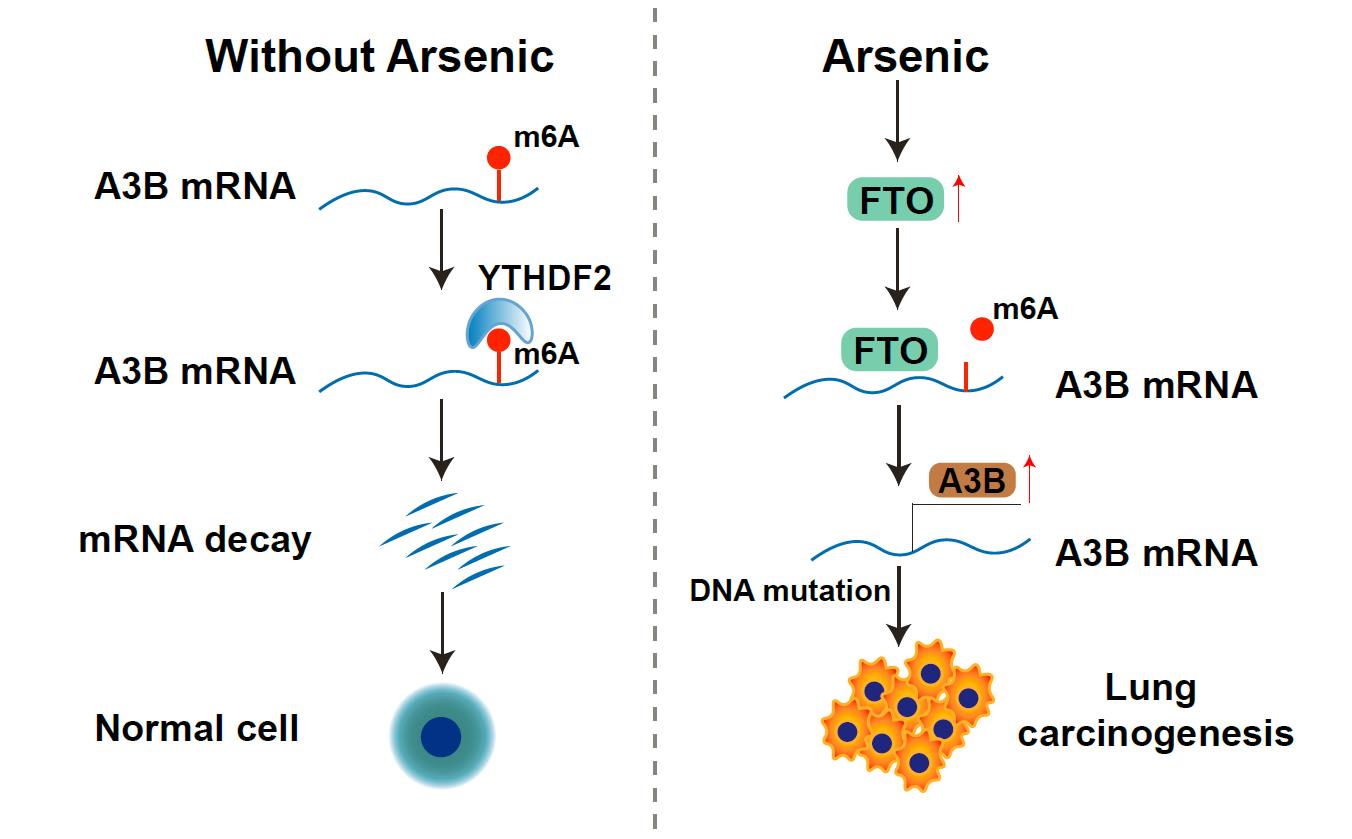
环境污染物砷的长期暴露可能导致癌症等相关疾病的发生,但目前人们对砷致癌的遗传和表观遗传毒性机制缺少深入认识。N6-methyladenosine(m6A)甲基化是真核生物RNA中含量最丰富的一种表观遗传修饰,在多种生理活动及疾病过程中发挥作用,但m6A修饰是否参与砷诱发的肺毒性尚不明确。课题组发现低剂量砷暴露下,肺脏细胞中胞嘧啶脱氨酶APOBEC3B的蛋白而非RNA水平表达显著上调,并且APOBEC3B介导了砷导致的肺细胞G/C到A/T突变增加。分子机制研究发现砷暴露下m6A去甲基化酶FTO的表达上调,它能通过去除APOBEC3B的CDS区域的m6A修饰促进APOBEC3B表达。另外甲基化阅读蛋白YTHDF2识别甲基化的APOBEC3B,与FTO协同调控砷暴露下APOBEC3B的mRNA稳定性,进而促进其表达水平以及DNA突变概率。最后通过人非小细胞肺癌组织芯片染色课题组发现肿瘤组织中FTO与A3B的高表达且显著正相关。该研究阐明m6A修饰在砷的人肺上皮细胞毒性效应中的作用及机制,可能为相关疾病的预警提供新的思路。
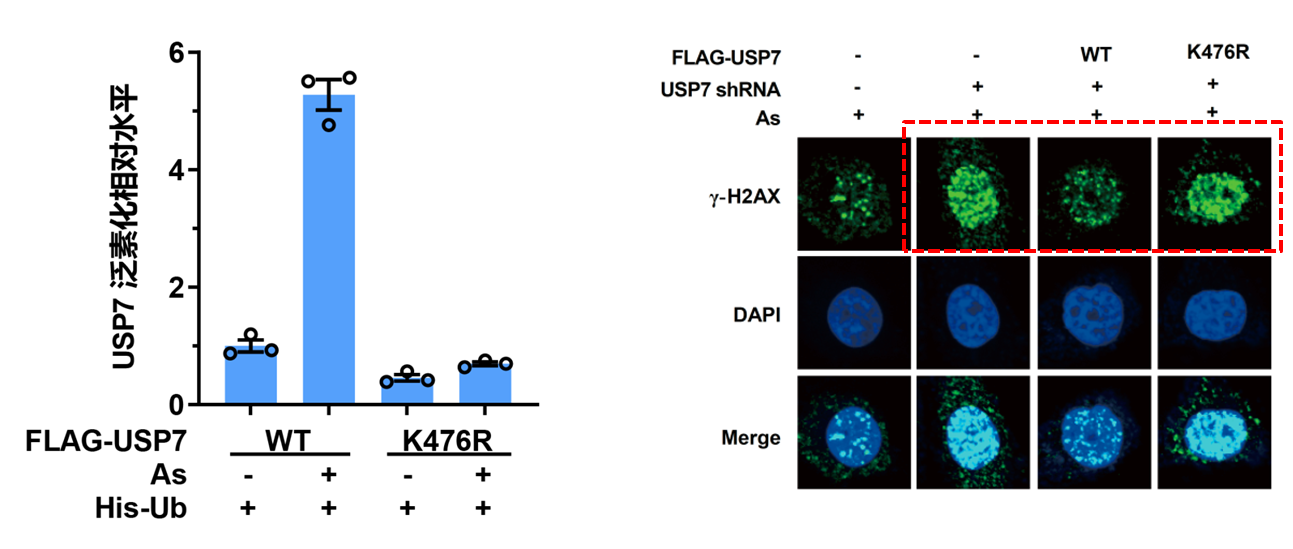
课题组同时发现低剂量砷可能通过促进氧化应激和DNA损伤影响肝癌的进展。去泛素化酶USP7在一系列癌症类型的肿瘤发生和治疗抗性中具有关键作用,但在污染物致癌性中的作用及机制仍不清楚。通过高通量定量质谱和蛋白组学研究,课题组发现砷暴露下USP7蛋白存在泛素化修饰并介导了USP7的活化。USP7活化后与其靶分子血红素加氧酶-1(HO-1)的结合增加,进而抑制HO-1蛋白的泛素化降解反应,从而降低砷诱发的氧化应激和DNA损伤;裸鼠成瘤实验发现USP7/HO-1通路活化对肝脏肿瘤的生长至关重要,同样通过肝癌组织芯片课题组进一步证实USP7和HO-1在肝癌组织中高表达且呈正相关性。该研究揭示了低剂量砷暴露下USP7/HO-1通路激活的分子机制,为砷暴露与肝癌发病的相关性提供新的理论依据。
课题组也发现碳纳米管暴露能够影响m6A甲基化酶METTL3/14的核内转运,从而发挥其肺毒性效应的化学生物学机制,明确羧基化多壁碳纳米管通过caveolin-1/WNT-b-catenin/METTL3/14通路影响肺上皮细胞线粒体自噬及周期阻滞的分子机理,揭示羧基化修饰在碳纳米管肺细胞毒性中的化学生物学机制。
以上研究得到了国家自然科学基金、国家重点研发计划和中科院青促会等项目的支持
论文链接详见:
https://doi.org/10.1016/j.jbc.2022.101563
https://doi.org/10.1038/s41388-022-02403-w
https://doi.org/10.1016/j.nantod.2022.101624
