

汪海林团队发现哺乳动物存在DNA 6mA新来源,发表于Cell Research
DNA N6-甲基腺嘌呤(N6-methyladenine, 6mA)是一种在原核生物中广泛存在的表观遗传修饰,在原核生物限制-修饰系统、基因表达调控、错配修复和转座子调控等过程中发挥重要作用。但是高等真核生物中6mA的存在一直是一个难解的谜。
2015年,汪海林组与陈大华组合作在Cell上发表了关于果蝇DNA 6mA修饰的研究成果,Cell同时分别了发表施杨教授、何川教授关于线虫和绿藻DNA 6mA的工作。此后,真核生物DNA 6mA修饰引起了广泛关注。哺乳动物6mA的研究也随后开启了新的里程。但是,由于哺乳动物DNA在样品制备和分析过程中,容易受到原核生物DNA污染,而原核生物6mA 水平远高于哺乳动物的,为哺乳动物DNA 6mA的准确检测与研究带来巨大挑战 。同时,研究人员也因此困惑:哺乳动物基因组DNA中是否存在复制后可遗传性的N6-腺嘌呤甲基化修饰?该问题一度引起业内广泛关注与争议,2017年发表在Angewandte Chemie论文以及近日发表在Science Advances上的文章未能检测到哺乳动物DNA 6mA修饰,而有关线虫中DNA 6mA修饰的检测也被认为有污染[1-3]。
此外,近日何川实验室的研究表明哺乳动物中的DNA 6mA修饰主要富集在线粒体DNA上(线粒体DNA修饰是总DNA修饰量的千倍以上),而线粒体以外的DNA修饰总量是极其低的,揭示了线粒体DNA 6mA修饰在哺乳动物线粒体活性调控和应激反应中的重要功能(Mol Cell | 何川团队揭示哺乳动物线粒体DNA中6mA修饰的存在和功能)。
值得注意的,围绕催化DNA 6mA修饰的酶类相关研究也存在争议,相关内容详见此前报道(Cell Research背靠背 | 李海涛、陈忠周团队分别发文揭示哺乳动物中DNA 6mA去甲基化酶ALKBH1的工作机制;Mol Cell | 又见新的DNA 6mA催化酶!)。
近日,中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室汪海林研究组发展了一套独有的、无污染的6mA分析方法,在哺乳动物细胞系中检测到的6mA并不依赖于甲基化转移酶,并发现了DNA聚合酶依赖的DNA 6mA新来源。相关工作以N6-methyladenine is incorporated into mammalian genome by DNA polymerase为题在Cell Research杂志上发表。

为了回答哺乳动物基因组中是否存在6mA以及6mA的来源这一科学问题,汪海林研究组发展了一套独有的、无污染的6mA分析方法,在样品预处理、超高效液相色谱串联质谱(UHPLC-MS/MS)分析中排除可能的原核生物DNA的污染,可获得准确的6mA信号。同时,他们所发展的DNA酶解方法保证了6mA的完全释放 (图1d)。利用这一先进的分析方法,在人细胞系HEK293T、hMSC、人胚胎干细胞hESC和小鼠胚胎干细胞 (mouse embryonic stem cells, mES细胞) DNA中检测到6mA (图1a,b)。原核生物支原体携带的高丰度6mA也是哺乳动物DNA 6mA分析偏差的重要来源之一。而这些细胞中均未检测到任何支原体的污染(图1c)。研究还发现,两种细胞周期抑制剂,即将细胞阻滞在late G1期的含羞草碱和将细胞阻滞在G1 期的palbociclib,分别处理细胞,均会导致6mA水平显著增加,发现了6mA可在细胞G1期累积。
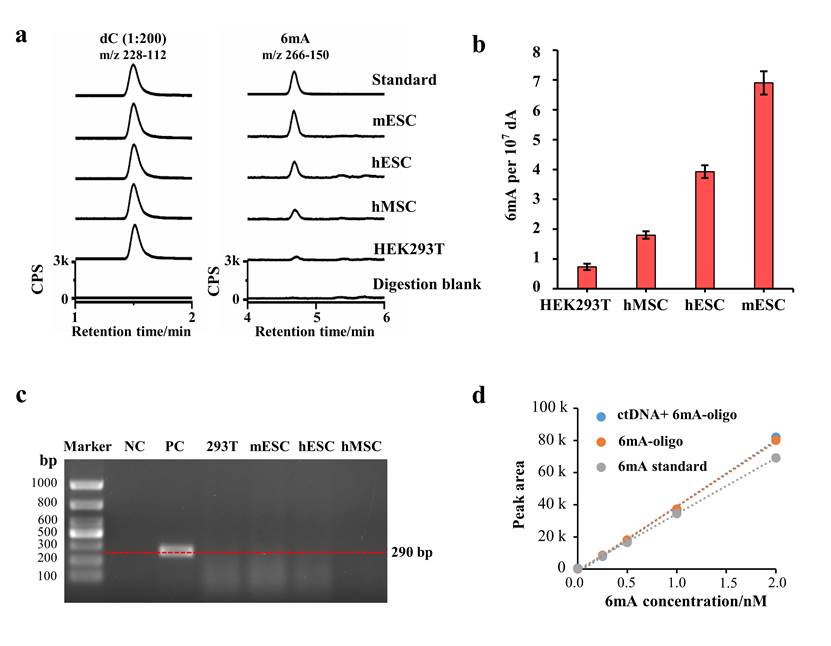
图1. UHPLC-MS/MS 分析哺乳动物细胞基因组DNA 6mA
为了进一步探索6mA的来源,该组采用他们研发的一种独特的稳定同位素标记方法(图2)。该法使用[15N5]-dA作为初始示踪剂处理细胞。其中,[15N5]-dA通过补救合成途径以[15N4]-dA的形式掺入基因组DNA中。他们前期的研究证明,该检测方法可识别支原体污染引入的6mA。支原体DNA中,同位素示踪剂的主要标记形式是[15N5]-dA,因而主要产生[15N5]-6mA[4]。同时,该法理论上也可用于识别哺乳动物细胞内甲基化转移酶产生的6mA ([15N4]-6mA)。
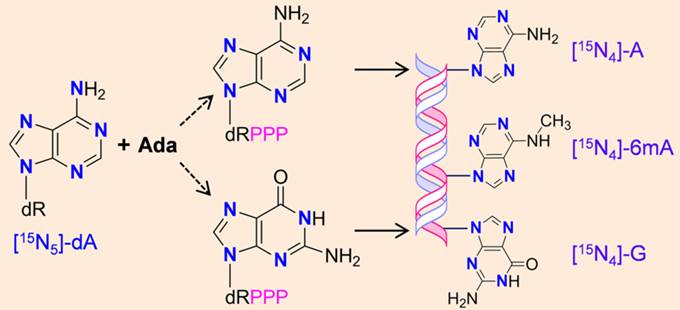
图2 以[15N5]-dA作为初始示踪剂的同位素标记法的示意图
研究发现,经[15N5]-dA处理后,细胞DNA被[15N4]-dA有效标记,但未能在mESC、hESC和HEK293T等细胞系、不同细胞周期(G1期、S期和G2/M期)中检测到任何[15N4]-6mA (图3a)。该研究采用了第二种同位素标记试剂,即[13CD3]-L-甲硫氨酸,可实现对mES细胞的有效标记。L-甲硫氨酸是甲基供体S-腺苷甲硫氨酸(SAM)的前体,同位素标记的甲基[13CD3]- SAM可经甲基化酶转移到底物上。结果显示,可以检测到未标记的6mA,但仍然未检检测到任何[13CD3]-6mA。而另一种DNA甲基化修饰5mC则检测到被标记的[13CD3]-5mC(标记率大于50%),说明[13CD3]-甲硫氨酸可以有效标记甲基化的碱基。以上结果表明,在哺乳动物细胞系中检测到的6mA并不依赖于甲基化转移酶。
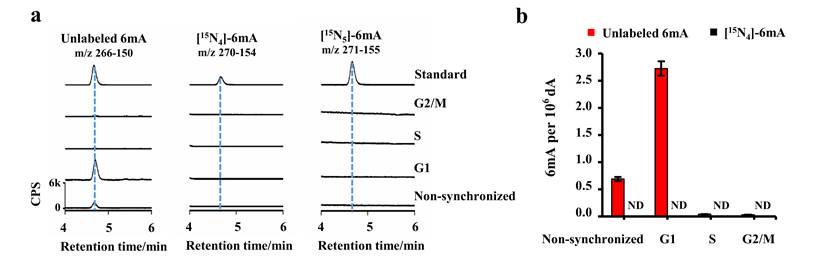
图3 mES细胞中未检测到甲基化酶催化形成的[15N4]-6mA
研究人员推测细胞内6mA来源于特定DNA聚合酶的活动。据此,采用6mA核苷直接处理mES细胞,基因组DNA中可检测到剂量依赖的6mA掺入。随后,分别用同位素标记的[15N5]-6mA和RNA核苷[CD3]-m6A处理细胞进行验证,可分别检测到[15N5]-6mA和[CD3]-6mA掺入。采用高保真Taq DNA聚合酶代表模板依赖的聚合酶进行验证,用N6-methyl-dATP (N6mdATP) 替代部分dATP,结果显示,6mA可以被聚合酶掺入PCR产物中。而当单体N6mdATP与dATP的比例降至1:1000时,产物中检测不到6mA,说明高保真Taq酶更倾向于使用dATP而非N6mdATP。
那么mES细胞6mA是如何进入基因组的呢?研究发现,与非同步化的细胞相比,G1期细胞中DNA聚合酶X家族成员非模板依赖性的Poly λ的mRNA表达增加,而Poly λ敲低则显著降低了G1期和sub G1期6mA水平。且Poly λ敲除可导致[CD3]-m6A处理掺入的6mA减少(图4)。
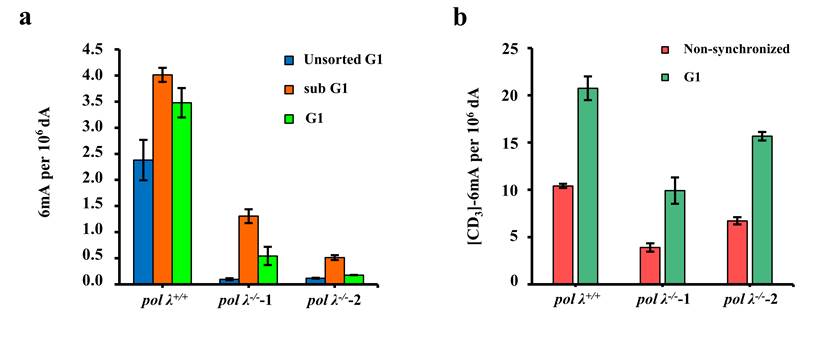
图4 Poly λ敲低或敲除减少6mA掺入
此外,为进一步研究mES细胞中DNA 6mA的来源,对可能的6mA 甲基化转移酶Mettl4和可能的去甲基化酶Alkbh1进行了考察。通过CRISPR/Cas9技术分别获得了两株mettl4和五株alkbh1敲除的细胞系。结果显示,mettl4敲除不能降低mES细胞基因组6mA水平。Alkbh1敲除的数据并不能支持Alkbh1是6mA去甲基化酶。另外,Alkbh1的敲除仍不能检测到甲基化转移酶依赖的DNA 6mA。
Michael U. Musheev等最近发表在Nature Chemical Biology的研究结果表明,细胞内RNA代谢中m6A可通过补救合成路径掺入基因组DNA[5]。该研究利用同位素标记证明DNA 6mA是通过来源于细胞内RNA m6A代谢掺入,但并未确定参与的DNA聚合酶。而汪海林研究组独立的研究表明,mES细胞经过[15N5]-dA处理后,RNA m6A以[15N4]-m6A的形式可有效被标记,但是经过4-10天的处理,均不能在DNA中检测到[15N4]-6mA。这些不同之处仍有待进一步研究。
总体而言,汪海林团队的研究通过利用独有的、无污染的UPHLC-MS/MS分析方法,检测到哺乳动物多种细胞基因组DNA 6mA的真实水平,并发现了DNA聚合酶依赖的DNA 6mA新来源(图5)。
图5 6mA通过DNA聚合酶掺入基因组DNA
刘晓玲博士、赖玮毅博士和博士生李瑶为论文的共同第一作者。徐国良院士及杜雅蕊博士参与了这一课题研究。
原文链接:
https://www.nature.com/articles/s41422-020-0317-6
参考文献
[1] Douvlataniotis K, Bensberg M, Lentini A, et al. No evidence for DNA N6-methyladenine in mammals. Science advances, 2020, 6(12): eaay3335.
[2] O'Brown Z K, Boulias K, Wang J, et al. Sources of artifact in measurements of 6mA and 4mC abundance in eukaryotic genomic DNA. BMC genomics, 2019, 20(1): 445.
[3] Schiffers S, Ebert C, Rahimoff R, et al. Quantitative LC–MS provides no evidence for m6dA or m4dC in the genome of mouse embryonic stem cells and tissues. Angewandte Chemie International Edition, 2017, 56(37): 11268-11271.
[4] Liu B, Liu X, Lai W, et al. Metabolically generated stable isotope-labeled deoxynucleoside code for tracing DNA N6-methyladenine in human cells. Analytical chemistry, 2017, 89(11): 6202-6209.
[5] Musheev M U, Baumgartner A, Krebs L, et al. The origin of genomic N6-methyl-deoxyadenosine in mammalian cells. Nature Chemical Biology, 2020, https://doi.org/10.1038/s41589-020-0504-2.