中国科学院生态环境中心环境化学与生态毒理学国家重点实验室汪海林研究组在DNA损伤修复方面取得重要进展,相关研究成果近日在线发表于Cell Discovery(ATPase activity tightly regulates RecA nucleofilaments to promote homologous recombination, doi:10.1038/celldisc.2016.53)。
环境污染物、电离辐射、药物化疗及细胞代谢等多种外源和内源因素能够引起各种形式的DNA损伤,其中DNA双链断裂对基因组稳定性的危害最严重,可威胁到细胞的生存。为了消除DNA双链断裂的威胁,从原核生物到真核生物(包括哺乳动物和人),均建立了一套复杂而精准的同源重组修复机制。具有DNA依赖性的ATP酶活性的RecA/Rad51家族蛋白,是同源重组修复通路的核心功能分子,可在单链DNA(ssDNA)上组装形成核蛋白丝(nucleoprotein filament),并通过快速、准确识别同源双链DNA(dsDNA)模板介导链交换过程,进而实现同源重组修复。具有活性的RecA/Rad51核蛋白丝的结构及其介导的链交换过程,一直以来是DNA修复研究的热点和难点。
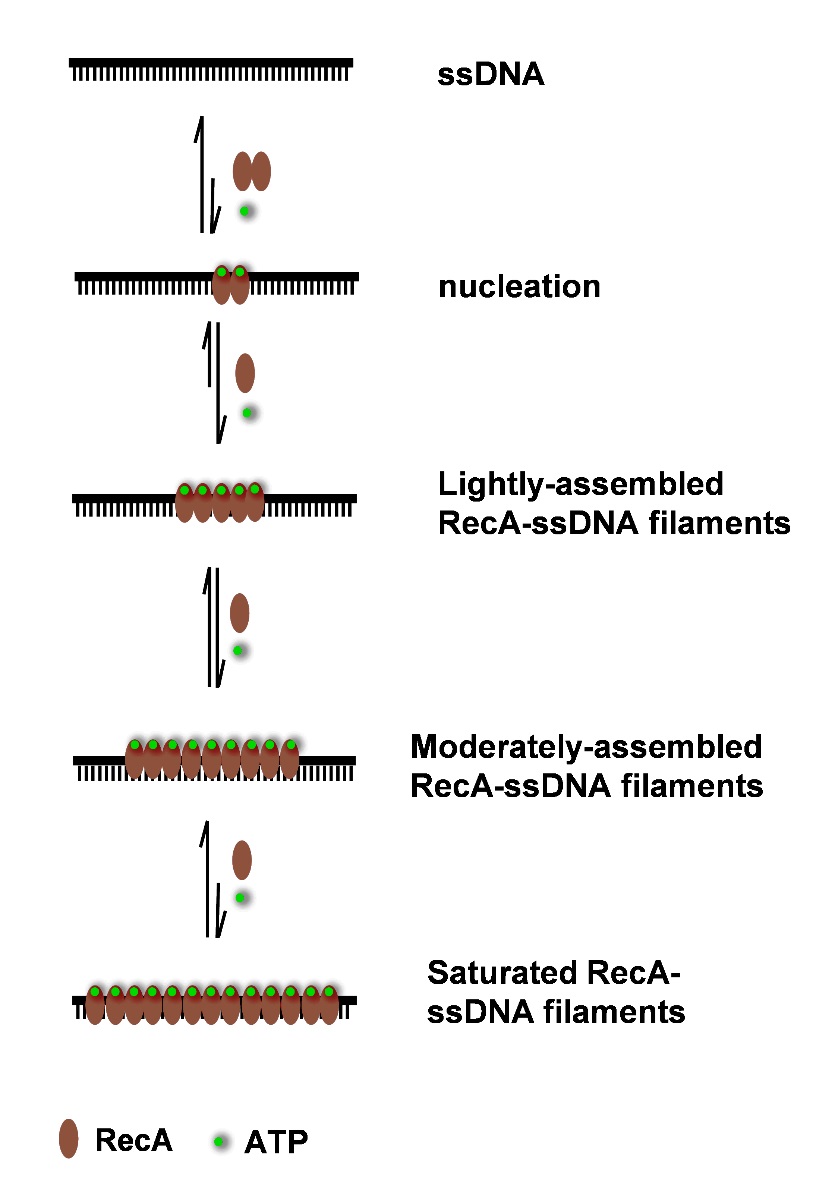
过去三十年的研究表明,RecA与ssDNA形成的核蛋白丝是一种刚性、已拉伸且欠旋的结构,其中ssDNA中每三个核苷结合一个RecA单体,并且ssDNA上所有核苷都为RecA单体占有,局部保留了B型DNA的构象。这种对称、完美的核蛋白丝结构已假定为介导同源重组的关键结构。但是,长期困扰人们的是:1)这种结构由于其固有的刚性如何能满足在存在大量非同源DNA且结构复杂的基因组中快速寻找到仅有1-2拷贝的同源DNA序列?2)这种结构主要是通过消除和抑制ATP水解而获得,但是在生理条件下核蛋白丝中的RecA可催化水解ATP,导致一定的RecA解离。因此,在生理条件下又如何能保证核蛋白丝结构的完整性?我们设想,在生理条件下,由于ATP的不断水解,相应地,RecA可解离,离去的RecA留下空位,引起新的RecA结合和组装,因此,将形成一种动态的RecA核蛋白丝。但是,当前的单分子分析等先进技术也难以测量RecA核蛋白丝的结合计量学,因此难以分析这种动态结构。汪海林研究组在前期研究工作(PNAS 2009, 106, 12849; JACS 2011, 133, 9188)的基础上,利用研制的毛细管电泳-激光诱导荧光偏振装置,并进一步发展了研究RecA在ssDNA上动态组装的分析新方法。利用新分析方法,可以快速捕获溶液中形成的各种RecA核蛋白丝组装体,并通过快速(2.5min)、高效的毛细管电泳分离各种RecA核蛋白丝。另外,通过设计电泳缓冲液可抑制ATP水解,防止RecA的解离,因此可有效保存这些已被捕获的RecA核蛋白丝组装体的本身结构。通过其电泳迁移行为的差异,可以准确测量这些RecA的结合计量学。利用这种新分析方法,他们发现,在生理条件下(即存在有效的ATP水解),RecA在ssDNA上组装可形成三种类型的核蛋白丝,包括高、中、低密度的核蛋白丝,但主要形成低密度、不饱和的核蛋白丝组装体,其中超过一半的DNA并未结合RecA蛋白,即裸露的。在线荧光偏振分析、电镜成像分析、酶切保护性分析等一致证明了这一结果。体外链交换反应实验表明,低密度、不饱和的核蛋白丝是介导链交换反应的关键组装体;相应地,多个ATP水解活性缺失的RecA突变体仅形成高密度核蛋白丝(缺少裸露的DNA)并不能介导链交换反应。为了考察这一机制是否存在于活体内,他们利用绿色荧光蛋白基因和一种稀有的DNA内切酶基因,设计了一套精密的活体同源重组修复报告体系。利用这套活体报告体系,并进一步设计一系列RecAP67位氨基酸突变体。他们的研究表明,RecA P67D和P67E体外仅形成低密度、不饱和的核蛋白丝组装体,在活体内可有效地介导同源重组修复。相反地,RecA P67R、P67K和P67Y拥有ATP水解酶活性,但不能形成低密度核蛋白丝组装体,难以介导活体同源重组修复。至此,通过一系列体外和活体实验,证明了介导同源重组修复的核蛋白丝的基本结构是由RecA蛋白通过ATP水解有限组装到单链DNA上形成的不饱和核蛋白丝组装体。这一发现是对传统同源重组修复的关键核蛋白丝组装体基础结构认识的一个重要改变,为深入理解同源重组修复机制提供理论依据。
本研究得到了中国科学院先导专项B、国家自然科学基金委的资助。
论文链接:http://www.nature.com/articles/celldisc201653